*Introducción a la química.

“La química es una ciencia que estudia la estructura, composición y propiedades de la materia.” Entendiendo el concepto de materia como todo lo que conforma los cuerpos, ocupa un espacio y tiene peso. Para introducirnos en el estudio de la química es necesario recordar algunos conceptos ya estudiados:
1. SUSTANCIAS PURAS.
“Son materiales formados por un solo tipo de partículas; son los elementos químicos y los compuestos químicos.”
Los elementos químicos están formados por un solo tipo de partícula llamado átomos, se hallan agrupados en la tabla periódica de los elementos químicos.
Los compuestos químicos son la combinación de dos o más elementos químicos, el combinarse cada elemento cambia sus propiedades y el compuesto toma otras propiedades diferentes de cada elemento; las partículas que forman los compuestos se llaman moléculas que son la unión de dos o más átomos.
“Es la mínima partícula de un elemento químico que conserva las propiedades de dicho elemento.” Los átomos de un elemento químico son iguales entre sí, pero son diferentes de los átomos de otro elemento químico.
3. PARTÍCULAS QUE CONFORMAN UN ÁTOMO.
Se hallan algunas partículas que conforman un átomo, son cargas eléctricas que le dan la estructura.
Las más notorias son: Protón, electrón y neutrón. También se les llaman partículas fundamentales.
PARTÍCULAS FUNDAMENTALES DEL ÁTOMO.
Partícula
|
Símbolo
|
Carga eléctrica
|
Ubicación
|
Neutrón
|
n
|
0
|
Núcleo
|
Protón
|
P+
|
+1
|
Núcleo
|
Electrón
|
e-
|
-1
|
Niveles de energía
|
4. NÚMERO ATÓMICO.
“Es el número que se le asigna a cada elemento químico, significa el número de protones (p+) que tiene un átomo de dicho elemento.” En la tabla periódica se halla en la parte superior del cuadro que corresponde a cada elemento, encima del símbolo. Se simboliza con la letra Z.
5. SÍMBOLO QUÍMICO.
“Es la abreviación del nombre de un elemento químico; si lo forma una letra se escribe con MAYÚSCULA, si lo forman dos letras la primera es MAYÚSCULA y la segunda minúscula”
Ejemplo: Hidrógeno: (H), Oxígeno (O), Litio: (Li), Mercurio (Hg).
Consideró el átomo como un sistema solar en miniatura; supuso que los electrones se mueven en niveles de energía alrededor del núcleo. El valor energético de estos niveles va aumentando a medida que se alejan del núcleo. Los niveles de energía se designan con las letras k, l, m, n, o, p, q, y también con los números 1, 2, 3, 4, 5, 6, 7 desde el núcleo hacia la periferia.
7. NIVELES DE ENERGÍA.
Los electrones en un átomo se hallan en continuo movimiento alrededor del núcleo. Los espacios posibles por donde se mueven se les llama niveles de energía. Cada nivel de energía puede tener un número máximo de electrones así:
Número máximo de electrones que puede tener cada nivel de energía.
Nivel
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|
Máximo de (e-)
|
2
|
8
|
18
|
32
|
50
|
72
|
98
|
8. SUBNIVELES DE ENERGÍA.
Estudios posteriores permitieron conocer que no todos los electrones que se hallan en un nivel tienen la misma energía, sino que para cada nivel de energía existen varios subniveles. Los subniveles se nombran con las letras s, p, d, f. cada subnivel puede tener un número máximo de electrones:
s = 2, p = 6, d = 10, f = 14.
Niveles y subniveles de energía.
NIVEL
|
SUBNIVELES DE ENERGÍA POR CADA NIVEL
| |||
K
|
s
| |||
L
|
s
|
p
| ||
M
|
s
|
p
|
d
| |
N
|
s
|
p
|
d
|
f
|
O
|
s
|
p
|
d
|
f
|
P
|
s
|
p
|
d
|
f
|
Q
|
s
|
p
|
d
|
f
|
9. DISTRIBUCION ELECTRÓNICA.
“Es la ubicación de los electrones en un átomo, teniendo en cuenta el número máximo de electrones que puede tener cada nivel de energía (K, L, M, N, O, P, Q,) o también (1, 2, 3, 4, 5, 6, 7.), y cada subnivel de energía (s, p, d, f.) para cada nivel.”

Por ejemplo: 1s2 El número 1 representa el nivel de energía, la letra s que lo acompaña representa el subnivel, y el número 2 que aparece con exponente es el número de electrones que se ubican en el subnivel.
La ubicación de los electrones del átomo se va llenando siguiendo el orden que indican las flechas en el gráfico hasta completar el número máximo de electrones por subnivel, luego se suman los electrones que hay en los subniveles de cada nivel de energía.
Veamos como ejemplo el átomo de Potasio (K) = Z: 19
Por tener 19 protones (P+) se le asigna el número atómico 19 (Z: 19), también tiene 19 electrones (e-) que se distribuyen en los niveles y subniveles de energía así:
1s2 2s2 2p6 3s2 3p6 4s1
Al sumar los electrones de los subniveles de cada nivel de energía tendremos:
Nivel 1 (K) hay 2 electrones, Nivel 2 (L) hay 2+6= 8 electrones, Nivel 3 (M) hay 2+6=8, Nivel 4 (N) hay 1 electrón.

La distribución de los electrones en cada nivel en el potasio es: K= 2, L= 8, M= 8, N= 1
EJERCICIO:
.Organice la distribución electrónica del átomo de Sodio (Na) Z: 11, Cloro (Cl) Z: 17, Calcio (Ca) Z: 20 y germanio (Ge) Z: 32.
.Organice la distribución electrónica del átomo de Sodio (Na) Z: 11, Cloro (Cl) Z: 17, Calcio (Ca) Z: 20 y germanio (Ge) Z: 32.
10. CAPA DE VALENCIA.
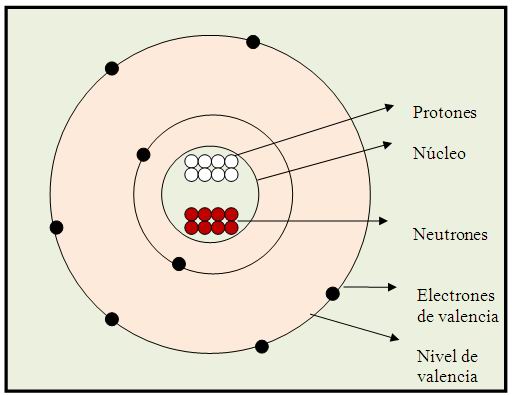

“Es el nivel de energía mas externo en un átomo, los electrones que se ubican en el nivel más externo se les llama electrones de valencia”
11. LEY DEL OCTETO.
“Un átomo puede tener máximo 8 electrones en la capa de valencia, si tiene menos de 8 electrones de valencia se dice que el elemento es inestable y puede unirse a otros átomos formando compuestos químicos, si tiene 8 electrones de valencia, el átomo es estable o inerte y no puede unirse a otros átomos para formar compuestos químicos.”
Los átomos de los elementos inestables tienden a completar sus 8 electrones de valencia tomando electrones de otros átomos, de esta forma comparten electrones generando enlaces químicos que mantienen unidos los átomos formando moléculas, dando origen a los compuestos químicos.
12. ENLACE QUÍMICO.


“Son las fuerzas de atracción que mantienen unidos los átomos formando moléculas. Los enlaces químicos están determinados por los electrones de valencia de los átomos.”
Los enlaces se dan por pérdida, ganancia o compartición de electrones entre los átomos que entran en reacción química.
* Para conocer aspectos de la tabla periódica visite la siguiente página:
* Para conocer aspectos de la tabla periódica visite la siguiente página:
* LA TABLA PERIÓDICA.
*Resuelva el siguiente cuestionario valiéndose de sus conocimientos, apuntes obtenidos de la clase, ayudas de esta esta página y consulta personal; debe entregar un trabajo escrito con las preguntas y las respuestas y sustentarlo.
1. Que es Ecología? Que importancia tiene?
2. Elabore el dibujo de un ecosistema y ubique sus componentes.
3. Defina los siguientes términos: Biotopo, Bicenosis, Población, Individuo, Factor biótico, Factor abiótico, consumidor, productor.
4. Elabore un dibujo que represente el Ciclo del Nitrógeno y explíquelo.
5. Explique los modelos atómicos de Dalton, Tomson y Bohr y dibújelos.
6. Desarrolle la distribución electrónica de los siguientes elementos químicos: Calcio, Silicio, Rubidio, Kriptón, Magnesio.
7. Explique que son electrones de valencia y ubíquelos en le punto anterior.
8. Explique que relación tienen los electrones de valencia y los grupos en la tabla periódica.
9. Que son los periodos en la tabla periódica y cual es su relación con los niveles de energía en un elemento químico?
Éxitos !
Cuestionario 3.
1. Que es Ecología? Que importancia tiene?
2. Elabore el dibujo de un ecosistema y ubique sus componentes.
3. Defina los siguientes términos: Biotopo, Bicenosis, Población, Individuo, Factor biótico, Factor abiótico, consumidor, productor.
4. Elabore un dibujo que represente el Ciclo del Nitrógeno y explíquelo.
5. Explique los modelos atómicos de Dalton, Tomson y Bohr y dibújelos.
6. Desarrolle la distribución electrónica de los siguientes elementos químicos: Calcio, Silicio, Rubidio, Kriptón, Magnesio.
7. Explique que son electrones de valencia y ubíquelos en le punto anterior.
8. Explique que relación tienen los electrones de valencia y los grupos en la tabla periódica.
9. Que son los periodos en la tabla periódica y cual es su relación con los niveles de energía en un elemento químico?
Éxitos !



No hay comentarios:
Publicar un comentario